合肥医疗试剂无尘室净化系统工程设计装修项目
来源:www.kqhjh.com 作者:空气好净化
发布时间:2021-08-18 10:31:55点击:次
一、项目概况
项目名称:医疗试剂无尘室净化系统工程设计装修
项目规模:5300㎡
洁净度: 万级、十万级
项目地址:安徽合肥

二、体外诊断试剂(医疗器械)洁净车间及实验室设计主要依据
1、医疗器械生产质量管理规范;
2、医疗器械监督管理条例;
3、体外诊断试剂生产实施细则;
4、医疗器械洁净室(区)检查要点指南(2014版);
5、无菌医疗器具生产管理规范(YY0033-2000);
6、医药工业洁净厂房设计规范(GB50457-2008);
7、洁净室及相关受控环境 第3部分:检测方法(GB/T 25915.3-2010)等

三、体外诊断试剂生产区域净化车间环境与控制要求

第一条 对生产环境有洁净度要求的产品除应当满足《体外诊断试剂生产实施细则》的通用要求外,其生产环境应当满足本附录的要求。不同的净化级别区域控制标准参见以下表格:
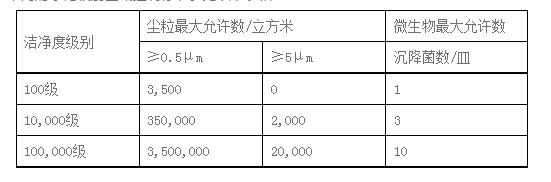
第二条 企业应当明确工艺所需的空气净化级别,进入洁净室(区)的空气必须净化。
阴性、阳性血清、质粒或血液制品的处理操作应当在至少10,000级环境下进行,与相邻区域保持相对负压,并符合防护规定。
酶联免疫吸附试验试剂、免疫荧光试剂、免疫发光试剂、聚合酶链反应(PCR)试剂、金标试剂、干化学法试剂、细胞培养基、校准品与质控品、酶类、抗原、抗体和其他活性类组分的配制及分装等产品的配液、包被、分装、点膜、干燥、切割、贴膜、以及内包装等工艺环节,至少应在100,000级净化环境中进行操作。无菌物料的分装必须在局部百级。
普通化学类诊断试剂的生产应在清洁环境(符合本细则第二十条规定)中进行。
第三条 厂房应当具有防止昆虫和其他动物进入的设施。
第四条 企业应当提供洁净区内生产工艺流程图和空气调节、配电照明等平/立面图。新建、改建、扩建的洁净区厂房应当提供有资质的设计单位设计的图纸。
第五条 在设计和建设厂房时,应当考虑使用时便于进行清洁工作。洁净室(区)的内表面应平整光滑、无裂缝、接口严密、无颗粒物脱落,并能耐受清洗和消毒,墙壁与地面的交界处宜成弧形或采取其他措施,以减少灰尘积聚和便于清洁。
第六条 洁净区应当配置空气消毒装置,有平面布置图、编号和使用记录。
第七条 洁净室(区)内各种管道、灯具、风口以及其他公用设施,在设计和安装时应考虑使用中避免出现不易清洁的部位。
第八条 洁净室(区)应当根据生产要求提供足够的照明。主要工作室的照度宜为300Lx;对照度有特殊要求的生产部位可设置局部照明。厂房应当具有应急照明设施。
第九条 洁净室(区)的窗户、天棚及进入室内的管道、风口、灯具与墙壁或天棚的连接部位均应密封。
第十条 更衣室、浴室及厕所的设置不应对洁净室(区)产生不良影响。
第十一条 洁净车间安全门向安全疏散方向开启,平时密封良好,紧急情况发生时应能保证畅通。
第十二条 洁净室(区)内应使用无脱落物、易清洗、易消毒的卫生工具,应当指定地点存放,存放地不应对产品造成污染。
第十三条 操作台(板)应光滑、平整、无缝隙、不脱落异物,便于清洗、消毒,不使用木质或油漆台面。
第十四条 洁净室(区)的空气如可循环使用应当采取有效措施避免污染和交叉污染。
第十五条 空气洁净级别不同的相邻房间之间的静压差应大于5帕,洁净室(区)与室外大气的静压差应大于10Pa,应配备监测静压差的设备,并定期监控。
第十六条 洁净室(区)的温度和相对湿度应当与试剂产品生产工艺要求相适应。
第十七条 洁净室(区)内安装的水池、地漏不得对物料产生污染。
第十八条 不同空气洁净度级别的洁净室(区)之间的人员及物料出入,应有防止交叉污染的措施。应当建立、执行物料进出洁净区的清洁程序,有脱外包装室、净化室和双层传递窗(或气闸室)。
第十九条 洁净室(区)和非洁净室(区)之间应有缓冲设施,洁净室(区)人流、物流走向应合
理。
第二十条 根据生产工艺要求,洁净室(区)内设置的称量室和备料室,空气洁净度级别应当与生产要求一致,并有捕尘和防止交叉污染的设施。
第二十一条 在净化车间内工作的人员应穿着符合要求的工作服。工作服的选材、式样及穿戴方式应与生产操作和空气洁净度级别要求相适应,并不得混用。洁净工作服的质地应光滑、不产生静电、不脱落纤维和颗粒性物质。无菌工作服必须包盖全部毛发、胡须及脚部,并能阻留人体脱落物。
第二十二条 不同空气洁净度级别使用的工作服应当分别清洗、整理,必要时消毒或灭菌。工作服洗涤、灭菌时不应带入附加的颗粒物质。工作服应制定清洗周期。100,00级以上区域的洁净工作服应当在洁净区内洗涤、干燥、整理,按要求灭菌。
第二十三条 洁净室(区)仅限于该区域生产操作人员和经批准的人员进入。
第二十四条 进入洁净室(区)的人员不得化妆和佩带饰物,不得裸手直接接触物料,洁净室(区)应定期消毒。使用的消毒剂不得对设备、物料和成品产生污染。消毒剂品种应定期更换,防止产生耐药菌株。
第二十五条 在净化车间内工作的生产人员应有健康档案。直接接触产品的生产人员每年至少体检一次。
第二十六条 应当建立、执行人员进出洁净区的清洁程序和管理制度,人员清洁程序合理。
第二十七条 洁净区的净化系统、消毒及照明等装置应按规定进行清洁、维护和保养并进行记录。
第二十八条 在净化车间内工作的生产人员应接受净化车间卫生管理制度、个人清洁卫生制度、净化车间使用管理制度等内容的培训,合格后持证上岗。
第二十九条 企业应当在验证的基础上明确规定洁净区环境监测的项目和频次,在静态检测合格前提下,企业应当按照规定进行洁净室(区)内空气温湿度、压差、风速、沉降菌和尘粒数的定期监测,并保存监测记录。
第三十条 生产激素类试剂组分的洁净室(区)应当采用独立的专用的空气净化系统,且净化空气不得循环使用。
第三十一条 强毒微生物操作区、芽胞菌制品操作区应与相邻区域保持相对负压,配备独立的空气净化系统,排出的空气不得循环使用。

